Moscow, Russian Federation
Russian Federation
To improve the quality of silage, lactic sourdoughs are now widely used. However, the finished high quality feed after air access gradually deteriorates under the influence of aerobic, acid-resistant microorganisms. The most popular compound for increasing aerobic stability is acetic acid. The effect of this acid was studied on plants belonging to the group of lightly consolidated with a sugar-buffer ratio from 2.9 to 3.2 and with an average dry matter content of green mass of 25.6%. Silage, in which the process of homofermentative lactic acid fermentation took place, had significant nutrient losses (on average, in the group of 12.0% dry matter) with rather rapid molding (4.2 days). During aeration, the average pH of this group increased from 4.06 to 5.61. The high level of correlation (0.78) between the content of acetic acid and the time of mold confirm its fungicidal properties. The correlation found, unfortunately, did not guarantee the same high correlation (–0.52) between the content of acetic acid and the loss of nutrients during aeration. This circumstance is apparently due to the high variability of nutrient losses at low levels of acetic acid concentration (less than 4.1% in the dry matter) due to the species composition of the microflora and the speed of its development at the initial stage of aerobic spoilage.
silage, aerobic spoilage, yeast, nutrient loss, mold colonies
Введение. Силосование является традиционным способом заготовки корма. Более того, этот процесс приобретает все большее значение, так как на крупных предприятиях силос постепенно начал вытеснять из рационов как сено, так и зеленую массу из свежескошенных трав.
В настоящее время широкое распространение получили молочнокислые закваски для повышения качества силоса, действие которых направлено на быстрое снижение рН за счет накопления молочной кислоты для предотвращения роста нежелательных микроорганизмов [1]. Как правило, для изготовления таких заквасок берут гомоферментативные молочнокислые бактерии [2]. Однако если в момент вскрытия такой силос характеризуется высокими показателями качества корма, то после доступа воздуха постепенно начинается рост и развитие аэробных, кислотоустойчивых микроорганизмов. В частности, дрожжи начинают пролиферировать, окисляя остаточные сахара, молочную кислоту и этанол. Основные их виды включают Candida, Hansenula, Pichia, Issatchenkia и Saccharomyces [3; 4]. Деградация молочной кислоты, вызванная дрожжами, увеличивает рН силоса до уровня, позволяющего условно-патогенным бактериям (например, бациллам) и плесени (например, Аспергиллу, Фузариуму и Пенсиллию) расти и далее снижать качество силоса [5; 6]. Так, по данным Ranjit и Kung [7] потери сухого вещества кукурузного силоса, подвергавшегося воздействию воздуха, всего за один–два дня оценивались в 6%. К тому же такой корм опасен для здоровья животных из-за микотоксинов, вырабатываемых нежелательными микроорганизмами [8; 9].
Более того, некоторыми авторами [10; 11] подмечено, что иногда силосы, приготовленные с использованием гомоферментативных молочнокислых бактерий, портились быстрее, чем аналоги без добавок. К сожалению, ни конечное значение рН корма, ни содержание молочной кислоты не влияют на аэробную стабильность [1; 12].
Основными соединениями, обладающими противогрибковыми свойствами при силосовании, являются уксусная, пропионовая, масляная кислоты, аммиак и пропанол. Сомнительно, что аммиак и пропанол можно получить естественным образом в концентрации, которая повлияла бы на популяцию дрожжей в силосе. По иронии судьбы, одной из самых эффективных является масляная кислота. Так, 1% масляной кислоты в сухом веществе кукурузного силоса увеличивает аэробную стабильность в два раза по сравнению с 4,4% уксусной кислоты [1]. Однако из-за вредных факторов, связанных с этим типом брожения, стремиться к ее накоплению в корме нельзя.
Наиболее популярной и более доступной для увеличения аэробной стабильности является уксусная кислота. Этому вопросу в последнее время посвящено много исследований. На рынке заквасок стали появляться препараты, созданные на основе гетероферментативных молочнокислых бактерий [13; 14], позволяющие увеличивать устойчивость силоса к воздействию неблагоприятной микрофлоры после его вскрытия. Однако исследований, посвященных вопросу о влиянии уровня уксусной кислоты на процессы, связанные с развитием неблагоприятной микрофлоры при попадании воздуха в корм не так и много. Исходя из важности этого вопроса, особую значимость приобретает работа, направленная на изучение процессов, происходящих в силосе после вскрытия.
Цель исследований — изучить степень влияния концентрации уксусной кислоты в силосе, приготовленном из многолетних трав с сахаро-буферным отношением около 3,0, для повышения аэробной стабильности полученного корма.
Методика исследований. Объект исследований: многолетние злаковые травы и злаково-бобовые смеси, убранные в фазу выхода в трубку – начала колошения, с сахаро-буферным отношением от 2,9 до 3,2.
Схема эксперимента. Исследования проводили на базе ФГБНУ «Федеральный научный центр кормопроизводства и агроэкологии имени В.Р. Вильямса». Для выяснения закономерностей влияния уксусной кислоты на потери питательных веществ от аэробной порчи и на время появления видимых колоний плесневых грибов проведено 18 опытов по силосованию трав со средним содержанием сухого вещества 25,6%. Все образцы силоса выдерживали в лабораторных сосудах емкостью 0,5 л в герметичном состоянии в течение двух месяцев. О готовности корма судили по окончанию выделения газов при силосовании, после чего в нем определяли уровень рН, содержание сухого вещества, аммиака и органических кислот. Затем силос в течение семи суток испытывали на его восприимчивость к аэробной порче и фиксировали время появление видимых колоний плесневых грибов.
Оборудование и технические средства. Содержание сухого вещества в зеленой массе и готовом силосе определяли путем высушивания навесок при температуре +105 ºС до постоянного веса, сахара — по Бертрану, аммиака — по Лонги, рН — с помощью потенциометра И-500, содержание органических кислот — методом капиллярного электрофореза на приборе «Капель 105М», буферную емкость растений определяли по методу Вайсбаха.
Статистическая обработка проведена с использованием t-критерия Стьюдента. Коэффициенты корреляции (r) рассчитывали с использованием компьютерной программы «Statistica» версии 6.
Результаты исследований. Исследования, посвященные аэробной стабильности, чаще всего проводились на кукурузном силосе, так как данный вид корма наиболее подвержен порче при доступе воздуха. Однако можно ли эти результаты соотносить с силосами из другого сырья с меньшим сахаро-буферным отношением? Так, Ю.А. Победнов в своих исследованиях наблюдал низкую интенсивность спиртового брожения на травах с сахаро-буферным отношением ≤ 2,5 [15] вследствие низкого содержания сахара в силосе из такого сырья. К тому же бобовые травы содержат вторичные метаболиты растений и их производные, которые сдерживают развитие дрожжей [6].
Поэтому силосы готовили из растений, относящихся к группе легкосилосующихся, с близким сахаро-буферным отношением от 2,9 до 3,2 и со средним содержанием сухого вещества в зеленой массе 25,6% (табл. 1).
1. Биохимические показатели взятых на исследование силосов
|
Силос |
Сахаро-буферное отношение |
рН |
Содержание в сухом веществе корма, % |
|||
|
аммиака |
органических кислот |
|||||
|
молочной |
уксусной |
масляной |
||||
|
Райграс пастбищный |
2,9 |
4,17 ± 0,02 |
0,21 ± 0,03 |
20,2 ± 0,17 |
3,4 ± 0,06 |
0,0 ± 0,00 |
|
2,9 |
3,82 ± 0,02 |
0,10 ± 0,03 |
22,7 ± 0,14 |
2,8 ± 0,02 |
0,0 ± 0,00 |
|
|
2,9 |
4,48 ± 0,02 |
0,27 ± 0,08 |
11,1 ± 0,11 |
4,8 ± 0,04 |
0,0 ± 0,00 |
|
|
2,9 |
4,06 ± 0,03 |
0,16 ± 0,01 |
18,2 ± 0,15 |
5,3 ± 0,11 |
0,0 ± 0,00 |
|
|
Фестулолиум Аллегро |
2,9 |
3,89 ± 0,04 |
0,07 ± 0,03 |
18,7 ± 0,11 |
1,8 ± 0,02 |
0,0 ± 0,00 |
|
2,9 |
4,28 ± 0,01 |
0,22 ± 0,04 |
15,8 ± 0,09 |
6,0 ± 0,03 |
0,0 ± 0,00 |
|
|
2,9 |
4,27 ± 0,03 |
0,14 ± 0,06 |
12,2 ± 0,06 |
5,5 ± 0,06 |
0,0 ± 0,00 |
|
|
Овсяница Кварта |
3,0 |
4,19 ± 0,04 |
0,29 ± 0,02 |
19,9 ± 0,16 |
3,7 ± 0,06 |
0,1 ± 0,05 |
|
3,0 |
4,03 ± 0,01 |
0,14 ± 0,02 |
18,2 ± 0,11 |
2,7 ± 0,02 |
0,0 ± 0,00 |
|
|
3,0 |
4,96 ± 0,02 |
0,26 ± 0,01 |
9,2 ± 0,09 |
5,3 ± 0,04 |
0,1 ± 0,01 |
|
|
3,0 |
4,23 ± 0,01 |
0,14 ± 0,01 |
17,2 ± 0,12 |
4,2 ± 0,02 |
0,0 ± 0,00 |
|
|
Фестулолиум Аллегро |
3,0 |
3,74 ± 0,02 |
0,06 ± 0,06 |
10,5 ± 0,09 |
2,0 ± 0,02 |
0,1 ± 0,01 |
|
Райграс однолетний |
3,2 |
4,03 ± 0,02 |
0,11 ± 0,05 |
17,4 ± 0,09 |
1,3 ± 0,03 |
0,0 ± 0,00 |
|
3,2 |
3,95 ± 0,01 |
0,13 ± 0,07 |
16,8 ± 0,09 |
1,8 ± 0,02 |
0,0 ± 0,00 |
|
|
3,2 |
4,39 ± 0,04 |
0,17 ± 0,09 |
12,2 ± 0,05 |
2,4 ± 0,02 |
0,0 ± 0,00 |
|
|
Тимофеечно-клеверная смесь |
3,2 |
4,08 ± 0,03 |
0,18 ± 0,06 |
14,7 ± 0,07 |
2,4 ± 0,02 |
0,0 ± 0,00 |
|
3,2 |
4,20 ± 0,01 |
0,21 ± 0,12 |
14,2 ± 0,06 |
3,6 ± 0,04 |
0,0 ± 0,00 |
|
|
3,2 |
4,38 ± 0,02 |
0,11 ± 0,10 |
11,1 ± 0,07 |
2,8 ± 0,05 |
0,0 ± 0,00 |
|
Для выполнения нашей задачи были взяты только образцы силосов с низким содержанием или полным отсутствием масляной кислоты, так как она обладает сильным фунгицидным действием, о чем уже было сказано выше.
Отобранные варианты силосов выдерживались в аэробных условиях при постоянной температуре 35 ºС на протяжении семи суток. В течение этого периода фиксировалось время появления видимых колоний плесневых грибов, а в конце опыта образцы анализировались по потерям питательных веществ и изменению рН в корме. Из всех вариантов только в восьми случаях силос оказался стабильным на протяжении этого периода. Для понимания природы этой стабильности мы решили проанализировать биохимические показатели силосов на момент закладки на опыт и условно разделили их на две группы по устойчивости к неблагоприятным процессам (табл. 2). К устойчивой группе мы отнесли силосы, в которых к концу опыта (семь суток) не отмечались потери питательных веществ и видимые колонии плесневых грибов.
2. Характеристика силосов по биохимическим показателям в среднем по группам
|
Группа |
n |
рН |
Содержание в сухом веществе корма, % |
|||
|
аммиака |
органических кислот |
|||||
|
молочной |
уксусной |
масляной |
||||
|
Устойчивая |
8 |
4,32 |
0,20 |
14,1 |
4,2 |
0,01 |
|
Неустойчивая |
10 |
4,06 |
0,14 |
16,8 |
2,5 |
0,02 |
Как было отмечено, качественный силос довольно неустойчив к воздействию неблагоприятной микрофлоры при вскрытии. Эта закономерность прослеживается и в нашей работе. Силос, который характеризовался более низким значением рН, содержанием аммиака и лучшим соотношением молочной и уксусной кислот, свидетельствующим о протекании гомоферментативного молочнокислого брожения, имел значительные потери питательных веществ (в среднем по группе — 12,0% СВ) при довольно быстром плесневении (4,2 суток). За время аэрации среднее значение рН этой группы возросло с 4,06 до 5,61.
Какова необходимая концентрация уксусной кислоты для ограничения негативных микробиологических процессов для такого сырья? Для ответа на этот вопрос было решено проанализировать корреляционные взаимосвязи между содержанием уксусной кислоты и потерями питательных веществ во время аэрации и временем появлении видимых колоний плесневых грибов (рис. 1).
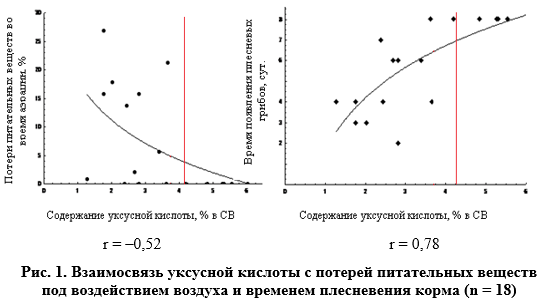
Высокий уровень корреляции (0,78) между содержанием уксусной кислоты и временем плесневения подтверждают ее фунгицидные свойства по отношению к грибам. Особенно они усиливаются при достаточно низком уровне рН в корме, потому как уксусная кислота в этот момент находится в недиссоциированной форме [1; 16]. Однако обнаруженная корреляционная связь, к сожалению, не гарантировала такой же высокой взаимосвязи (–0,52) между содержанием уксусной кислоты и потерями питательных веществ во время аэрации (табл. 3).
Данное обстоятельство, видимо, связано с высокой вариативностью потерь питательных веществ при низких уровнях концентрации уксусной кислоты (менее 4,1% в СВ) из-за видового состава микрофлоры и скорости ее развития на начальном этапе аэробной порчи. Китайские ученые показали [17], что в зависимости от различных биохимических показателей корма и продолжительности его силосования аэробная порча будет вызываться различными видами дрожжей и аэробных бактерий. Так, например, в образцах, вскрытых после 48 часов с начала силосования, доминирующее развитие получили дрожжи вида Candida ethanolica, C. rugosa, а в этом же силосе даже с высокой концентрацией молочной и уксусной кислот, вскрытом после 56 дней, — Zygosaccharomyces bailii.
3. Взаимосвязь потерь питательных веществ в течение семисуточной аэрации
с изменением рН в корме при доступе воздуха
|
Потери питательных веществ, % |
Содержание уксусной кислоты в СВ, % |
рН на момент вскрытия корма |
рН после семи суток аэрации |
Разница рН за период эксперимента |
|
0,0 |
5,26 |
4,96 |
4,77 |
–0,19 |
|
0,0 |
4,19 |
4,23 |
4,14 |
–0,09 |
|
0,0 |
4,83 |
4,48 |
4,47 |
–0,01 |
|
0,0 |
5,31 |
4,06 |
4,01 |
–0,05 |
|
0,0 |
6,01 |
4,28 |
4,41 |
0,13 |
|
0,0 |
5,54 |
4,27 |
4,30 |
0,03 |
|
0,0 |
2,39 |
4,08 |
4,15 |
0,07 |
|
0,0 |
3,62 |
4,20 |
4,26 |
0,06 |
|
0,0 |
2,81 |
4,38 |
4,52 |
0,14 |
|
0,8 |
1,28 |
4,03 |
4,12 |
0,09 |
|
2,1 |
2,68 |
4,03 |
4,64 |
0,61 |
|
5,6 |
3,39 |
4,17 |
5,77 |
1,60 |
|
13,7 |
2,44 |
4,39 |
5,83 |
1,44 |
|
15,7 |
1,76 |
3,89 |
4,74 |
0,85 |
|
15,7 |
2,81 |
3,82 |
4,75 |
0,93 |
|
17,8 |
2,02 |
3,74 |
6,40 |
2,66 |
|
21,3 |
3,65 |
4,19 |
8,52 |
4,33 |
|
26,9 |
1,76 |
3,95 |
6,78 |
2,83 |
Более того, считается, что силос с высокой популяцией дрожжей (> 105 КОЕ/г) обладает низкой аэробной стабильностью [5]. Однако Nishino с соавторами [18] в своей статье отмечали, что наблюдали высокую устойчивость силоса, в котором было более 106 КОЕ/г дрожжей, вскрытого после 90 дней консервирования. На этом основании они пришли к выводу о том, что аэробная стабильность не имеет значительной корреляции с количеством дрожжей, но может быть тесно связана с их доминирующими видами в корме.
То же самое можно сказать и об уксуснокислых бактериях. Так, Bacterium vini acetati окисляет уксусную кислоту только в пределах рН среды, равной 4,60–5,65, а Bac. rancens — от 3,1 до 4,8 [19].
Несмотря на это, именно дрожжам исследователи [17; 10] отводят главную роль в начале процесса аэробной порчи, при которой грибы, окисляя органические кислоты, повышают рН корма, хранящегося на воздухе, что приводит к высоким потерям питательных веществ. Исходя из этого, нами также получена высокая корреляционная связь, равная 0,87 на силосах с содержанием уксусной кислоты менее 4,1% в СВ между потерями питательных веществ при доступе воздуха и разницей рН за период эксперимента (рН силоса сразу после вскрытия и по истечению семисуточного хранения на воздухе).
Небольшая отрицательная разница рН по итогам эксперимента получилась в некоторых силосах с содержанием уксусной кислоты более 4,1% в СВ. По нашему мнению, это обстоятельство объясняется тем, что в корме присутствовало небольшое количество спиртов, которые являются более благоприятным энергетическим субстратом, чем уксусная кислота для уксуснокислых бактерий [15; 19]. В данном случае они не только не приводят к более быстрой порче корма, но и способствуют увеличению его аэробной стабильности за счет перевода спирта в уксусную кислоту.
Заключение. Исходя из вышеперечисленных результатов, мы считаем, что для устойчивости к потерям питательных веществ от аэробной порчи в течение семи суток и увеличения времени появления видимых колоний плесневых грибов в силосе, приготовленном из растительного сырья с сахаро-буферным отношением 2,8–3,2, необходимо содержание уксусной кислоты не менее 4,1% в СВ. К похожему результату пришли и зарубежные ученые. Так, Danner H. и др. [1] сделали свое заключение на основе экспериментов, проведенных на кукурузе, в которых при концентрации уксусной кислоты в силосе 4,4% в СВ аэробная порча наступала через 92 часа, а при 6,6% — 150 часов. А по мнению Pahlow G. и Weissbach F. [21], на злаковых культурах этот результат достижим при содержании уксусной кислоты 3,5% в СВ и более.
1. Danner H., Holzer M., Mayrhuber E., Braun R. Acetic acid increases stability of silage under aerobic conditions. Applied Environ Microbiol. 2003 Jan.; 69 (1): 562-567.
2. Pobednov YU.A., Osipyan B.A. Preparaty molochnokislyh bakterij pri silosovanii: teoriya, problemy i perspektivy primeneniya [Elektronnyj resurs] // Adaptivnoe kormoproizvodstvo. - 2013. - № 1. - S. 21-30. - URL: http: www.adaptagro.ru.
3. Wilkinson J.M., Davies D.R. The aerobic stability of silage: key findings and recent developments. Grass and forage science. 68 (1), March, 2013. P. 1-19.
4. Inglis G.D., Yanke L.J., Kawchuk L.M. and McAllister T.A. 1999. The influence of bacterial inoculants on the microbial ecology of aerobic spoilage of barley silage. Can. J. Microbiol. 45: 77-87.
5. McDonald P., Henderson N. and Heron S.J.E. (eds.). 1991. The Biochemistry of Silage. Second Edition. Chalcombe Publications, Bucks, England. 340 r.
6. Vajsbah F. Budushchee konservirovaniya kormov // Problemy biologii produktivnyh zhivotnyh. - 2012. - № 2. - S. 49-70.
7. Ranjit N.K. and Kung L.Jr. 2000. The effect of Lactobacillus buchneri, L. plantarum, or a chemical preservative on the fermentation and aerobic stability of corn silage. J. Anim. Sci. 83: 526-535.
8. Schmidt R.J., Kung L.Jr. The effects of Lactobacillus buchneri with or without a homolactic bacterium on the fermentation and aerobic stability of corn silages made at different locations. J. Dairy Sci. 2010. 93: 1616-1624.
9. Pobednov YU.A., Sokolova O.N., Mamaev A.A. Soderzhanie mikotoksinov v korme pri raznyh sposobah silosovaniya i senazhirovaniya trav // Problemy biologii produktivnyh zhivotnyh. - 2017. - № 2. - S. 51-59.
10. Weinberg Z.G., Ashbell G., Hen Y., Azrieli A. The effect of applying lactic acid bacteria at ensiling on the aerobic stability of silages. J. Appl. Bacteriol. 1993. 75: 512-518.
11. Muck R.E. and Kung L.Jr.. 1997. Effect of silage additives on ensiling. Proceedings of the conference on Silage: Field to feedbunk. North American Conference Hershey, PA. NRAES99.
12. Beck T., Groß F., Beck R. 1987. Untersuchungen zur Kenntnis der Gärfuttermikroflora. II Mitteilung: Die Milchsäurebakterienflora von Silagen unterschiedlicher Qualität aus Praxisbetrieben. Wirtschafsteigene Futter. 33: 34-43.
13. Szucs J.P., Suli A., Meszaros A., Bodnar E.S., Avasi Z. Use of Biological Additives with Grass Containing Medium and High Levels of WSC for Effective Conservation and Aerobic Stability. Animal Science and Biotechnologies, 2012, 45 (1), p. 96-100.
14. Kosolapova V.G., Osipyan B.A., Mamaev A.A. Ispol'zovanie biologicheskih preparatov pri silosovanii zlakovyh kul'tur // Kormoproizvodstvo. - 2018. - № 6. - S. 27-32.
15. Pobednov YU.A., Mamaev A.A. Intensivnost' spirtovogo brozheniya v zavisimosti ot stepeni provyalivaniya i obespechennosti kormovyh trav saharom i ego rol' v vozniknovenii aerobnoj porchi silosa i senazha [Elektronnyj resurs] // Adaptivnoe kormoproizvodstvo. - № 1. - 2019. - S. 55-67. - URL: http: www.adaptagro.ru.
16. Wolthusen E., Weissbach F. and Derno M. (1989): Fermentation acid content and aerobic stability of silages. In: F. Weissbach (ed.) Proceedings International Symposium on Production, Evaluation and Feeding of Silage. June 12-16 in Rostock, ILID-Druckerei Berlin, Germany, 123-132.
17. Hao W., Wang H.L., Ning T.T., Yangl F.Y., Xu C.C. Aerobic Stability and Effects of Yeasts during Deterioration of Non-fermented and Fermented Total Mixed Ration with Different Moisture Levels. Asian-Australasian Journal of Animal Sciences (AJAS). 2015; 28 (6): 816-826.
18. Nishino N., Wada H., Yoshida M., Shiota H. Microbial counts, fermentation products, and aerobic stability of whole crop corn and a total mixed ration ensiled with and without inoculation of Lactobacillus casei or Lactobacillus buchneri. J. Dairy Sci. 2004. 87: 2563-2570.
19. Dratvina T.V. Okislenie uksusnokislymi bakteriyami spirta i uksusnoj kisloty v zavisimosti ot rN i drugih uslovij sredy // Mikrobiologiya. - Tom VI. Vyp. 4. - 1937. - S. 458-480.
20. Laptev G.YU., Hamitova N.R. Aerobnaya stabil'nost' silosa // Sel'skohozyajstvennye vesti. -2013. - № 2. - S. 30.
21. Pahlow G. Praxishandbuch Futterkonservierung. 7th ed. DLG Verlag. 2006. ISBN 3 7690 0677 1, 18-19.








